పీరియడ్ (ఆవర్తన పట్టిక)
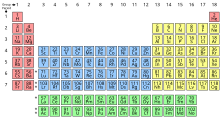
ఆవర్తన పట్టికలో పీరియడ్, రసాయన మూలకాల అడ్డువరుస. ఒక అడ్డువరుస లోని మూలకాలన్నీ ఒకే సంఖ్యలో ఎలక్ట్రాన్ షెల్లను కలిగి ఉంటాయి. ఒక పీరియడ్ లోని ప్రతి తదుపరి మూలకం లోను ఒక ప్రోటాన్ ఎక్కువ ఉంటుంది. దాని ముందున్న దాని కంటే తక్కువ లోహంగా ఉంటుంది. ఈ విధంగా అమర్చబడినప్పుడు, ఒకే గ్రూపు (నిలువు వరుస) లోని మూలకాలు ఒకే విధమైన రసాయనిక, భౌతిక లక్షణాలను కలిగి ఉంటాయి. ఇది ఆవర్తన నియమాన్ని ప్రతిబింబిస్తుంది. ఉదాహరణకు, హాలోజన్లు చివరి నుండి రెండవ గ్రూపు (గ్రూప్ 17) లో ఉంటాయి. వీటన్నిటికీ అధిక రియాక్టివిటీ ఉంటుంది. జడ వాయువుల ఎలక్ట్రాన్ కాన్ఫిగరేషన్కు చేరుకోవడానికి ఒక ఎలక్ట్రాన్ను పొందడం వంటి సారూప్య లక్షణాలు వీటికి ఉంటాయి. 2021 నాటికి మొత్తం 118 మూలకాలను కనుగొన్నారు.

ఆధునిక క్వాంటం మెకానిక్స్, ఎలక్ట్రాన్ షెల్స్ పరంగా లక్షణాలలో ఉండే ఈ ఆవర్తన పోకడలను వివరిస్తుంది. పరమాణు సంఖ్య పెరిగేకొద్దీ, ఆర్డరింగ్ రూల్ రేఖాచిత్రంలో చూపిన క్రమంలో షెల్లు ఎలక్ట్రాన్లతో నింపబడతాయి. ప్రతి షెల్ యొక్క పూరకం పట్టికలోని వరుసకు అనుగుణంగా ఉంటుంది.
ఆవర్తన పట్టికలోని s-బ్లాక్, p-బ్లాక్లలో, ఒకే పీరియడ్లో ఉన్న మూలకాలు సాధారణంగా లక్షణాలలో పోకడలు సారూప్యతలను ప్రదర్శించవు. అయితే, డి-బ్లాక్లో, పీరియడ్స్లో పోకడలు ముఖ్యమైనవిగా మారతాయి. ఎఫ్-బ్లాక్ లో, అన్ని పీరియడ్స్ లోనూ ఆయా పీరియడ్లో ఉండే మూలకాల్లో అధిక స్థాయిలో సారూప్యత ఉంటుంది.
పీరియడ్లు
[మార్చు]ఆవర్తన పట్టికలో ప్రస్తుతం ఏడు పూర్తి పీరియడ్లు ఉన్నాయి. ఇందులో 118 తెలిసిన మూలకాలు ఉన్నాయి. ఏదైనా కొత్త మూలకాలు కనుగొంటే వాటిని ఎనిమిదో పీరియడ్లో ఉంచుతారు. మూలకాలు వాటి బ్లాక్ ను బట్టి క్రిందివిధంగా రంగు సూచించబడింది: s-బ్లాక్కు ఎరుపు, p-బ్లాక్కు పసుపు, d-బ్లాక్కు నీలం, f-బ్లాక్కు ఆకుపచ్చ.
పీరియడ్ 1
[మార్చు]| గ్రూపు | 1 | 18 |
|---|---|---|
| పరమాణు # పేరు |
1 H |
2 He |
మొదటి పీరియడ్లో హైడ్రోజన్, హీలియం అనే రెండు మూలకాలున్నాయి. అందువల్ల అవి ఆక్టెట్ నియమాన్ని అనుసరించవు. దాని బదులు డ్యూప్లెట్ నియమాన్ని అనుసరిస్తాయి. రసాయనికంగా, హీలియం ఒక జడ వాయువు లాగా ప్రవర్తిస్తుంది. అందువలన దీన్ని గ్రూపు 18 మూలకాలలో భాగంగా తీసుకుంటారు. అయితే, దాని అణు నిర్మాణం పరంగా ఇది s-బ్లాక్కు చెందినది, అందువలన కొన్నిసార్లు గ్రూపు 2 మూలకం లేదా ఏకపీరియడ్లో 2, 18 రెండిటిగానూ వర్గీకరించబడుతుంది. హైడ్రోజన్ తక్షణమే ఎలక్ట్రాన్ను కోల్పోతుంది, పొందుతుంది, కాబట్టి రసాయనికంగా గ్రూపు 1, గ్రూపు 17 మూలకం లాగా ప్రవర్తిస్తుంది.
- హైడ్రోజన్ (H), రసాయన మూలకాలలో అత్యంత సమృద్ధిగా ఉంటుంది, విశ్వపు మూలక ద్రవ్యరాశిలో ఇది దాదాపు 75% ఉంటుంది. [1] అయోనైజ్డ్ హైడ్రోజన్ అంటే కేవలం ప్రోటానే. ప్రధాన శ్రేణిలోని నక్షత్రాలు ప్రధానంగా దాని ప్లాస్మా స్థితిలో హైడ్రోజన్తో కూడి ఉంటాయి. మూలక హైడ్రోజన్ భూమిపై చాలా అరుదుగా ఉంటుంది. మీథేన్ వంటి హైడ్రోకార్బన్ల నుండి పారిశ్రామికంగా ఉత్పత్తి చేయబడుతుంది. హైడ్రోజన్ చాలా మూలకాలతో సమ్మేళనాలను ఏర్పరుస్తుంది. నీటిలోను, చాలా సేంద్రీయ సమ్మేళనాలలోనూ ఇది ఉంటుంది.
- హీలియం (He) విపరీతమైన పరిస్థితుల్లో తప్ప వాయువుగా మాత్రమే ఉంటుంది. [2] ఇది రెండవ-తేలికపాటి మూలకం. విశ్వంలో రెండవ అత్యంత సమృద్ధిగా ఉండే మూలకం. [3] బిగ్ బ్యాంగ్ సమయంలో చాలా హీలియం ఏర్పడింది, అయితే నక్షత్రాలలో హైడ్రోజన్ను న్యూక్లియర్ ఫ్యూజన్ చేయడం ద్వారా కొత్తగా హీలియం ఏర్పడుతూ ఉంటుంది. [4] భూమిపై హీలియం చాలా అరుదు. కొన్ని రేడియోధార్మిక మూలకాల యొక్క సహజ క్షయం చెందేక్రమంలో ఉప ఉత్పత్తిగా మాత్రమే సంభవిస్తుంది. [5] అటువంటి 'రేడియోజెనిక్' హీలియం, ఏడు శాతం వరకు సహజ వాయువులో ఉంటుంది. [6]
పీరియడ్ 2
[మార్చు]| గ్రూపు | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|
| పరమాణు # పేరు |
3 Li |
4Be | 5 B |
6 C |
7 | 8O | 9 F |
10 Ne |
పీరియడ్ 2 మూలకాలు 2s, 2p కక్ష్యలను కలిగి ఉంటాయి. వాటిలో హైడ్రోజన్తో పాటు జీవశాస్త్రపరంగా అత్యంత ముఖ్యమైన మూలకాలైన కార్బన్, నైట్రోజన్, ఆక్సిజన్ లు ఉన్నాయి.
- లిథియం (Li) తేలికైన లోహం, అతి తక్కువ సాంద్రత కలిగిన ఘన మూలకం. [7] అయనీకరణం కాని స్థితిలో ఇది అత్యంత రియాక్టివ్ మూలకాలలో ఒకటి. కాబట్టి ఇది సహజంగా సమ్మేళనాలలో మాత్రమే లభిస్తుంది. ఇది బిగ్ బ్యాంగ్ సమయంలో పెద్ద పరిమాణంలో తయారైన అత్యంత భారీ ఆదిమ మూలకం.
- బెరీలియం (Be) అన్ని తేలికపాటి లోహాలలో కెల్లా అత్యధిక ద్రవీభవన బిందువు కలిగిన మూలకాల్లో ఒకటి. బిగ్ బ్యాంగ్ సమయంలో చిన్న మొత్తాలలో బెరీలియం సంశ్లేషణ అయినప్పటికీ తదనంతరం అది కార్బన్, నత్రజని, ఆక్సిజన్ వంటి పెద్ద కేంద్రకాలను సృష్టించే క్రమంలో నక్షత్రాలలో ఎక్కువ భాగం క్షీణించింది. బెరీలియంను ఇంటర్నేషనల్ ఏజెన్సీ ఫర్ రీసెర్చ్ ఆన్ క్యాన్సర్ గ్రూప్ 1 కార్సినోజెన్గా వర్గీకరించింది. [8] 1% నుండి 15% వరకూ వ్యక్తులు బెరీలియంకు సున్నితంగా ఉంటారు. వారి శ్వాసకోశ వ్యవస్థలో, చర్మంలో బెరీలియం వ్యాధి అని పిలువబడే ఒక చర్య జరగవచ్చు. [9]
- బోరాన్ (B) సహజంగా స్వేచ్ఛా మూలకంగా లభించదు. బోరేట్స్ వంటి సమ్మేళనాలలో లభిస్తుంది. వృక్షాల్లో కణ గోడ బలానికి, అభివృద్ధికి, కణ విభజన, విత్తనం, పండ్ల అభివృద్ధి, చక్కెర రవాణాకు, హార్మోన్ల అభివృద్ధికీ ఇది ఒక ఆవశ్యకమైన సూక్ష్మపోషకం. [10] [11] అధిక స్థాయిల్లో ఉంటే ఇదే విషప్రాయం అవుతుంది.
- కార్బన్ (C) హైడ్రోజన్, హీలియం, ఆక్సిజన్ ల తర్వాత ద్రవ్యరాశి పరంగా విశ్వంలో నాల్గవ-అత్యంత సమృద్ధిగా ఉన్న మూలకం. [12] ఆక్సిజన్ తర్వాత ద్రవ్యరాశి పరంగా మానవ శరీరంలో రెండవ అత్యంత సమృద్ధిగా ఉన్న మూలకం, పరమాణువుల సంఖ్యను బట్టి మూడవ-అత్యంత సమృద్ధి మూలకం. C-C బంధాల పొడవైన స్థిరమైన గొలుసులను ఏర్పరుచుకునే కార్బన్ సామర్థ్యం కారణంగా కార్బన్ను కలిగి ఉండే సమ్మేళనాలు అనంతంగా ఉన్నాయి. [13] జీవితానికి అవసరమైన అన్ని సేంద్రీయ సమ్మేళనాలలో కనీసం ఒక కార్బన్ పరమాణువు ఉంటుంది. [13] [14] హైడ్రోజన్, ఆక్సిజన్, నైట్రోజన్, సల్ఫర్, భాస్వరం ల లాగా, కార్బన్ కూడా ప్రతి ముఖ్యమైన జీవ సమ్మేళనానికి ఆధారం. [15]
- నత్రజని (N) ప్రధానంగా జడ డయాటోమిక్ వాయువు. ఇది N2 గా లభిస్తుంది. భూమి వాతావరణంలో 78% ఉంటుంది. ఇది ప్రోటీన్ల యొక్క ముఖ్యమైన భాగం.
- ఆక్సిజన్ (O) వాతావరణంలో 21% ఉంటుంది. అన్ని జంతువులకు శ్వాసక్రియకు అవసరం. అలాగే నీటిలో ఇది ప్రధాన భాగం. ఆక్సిజన్ విశ్వంలో మూడవ అత్యంత సమృద్ధిగా ఉన్న మూలకం. ఆక్సిజన్ సమ్మేళనాలు భూమి పైపెంకులో ఆధిపత్యం చెలాయిస్తాయి.
- ఫ్లోరిన్ (F) అయనీకరణం కాని స్థితిలో అత్యంత రియాక్టివుగా ఉండే మూలకం, కాబట్టి ప్రకృతిలో ఇది స్వస్వరూపంలో ఎప్పుడూ లభించలేదు.
- నియాన్ (నే) నియాన్ లైటింగ్లో ఉపయోగించే ఒక ఉత్కృష్ట వాయువు .
పీరియడ్ 3
[మార్చు]| గ్రూపు | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|
| పరమాణు # పేరు |
11 | 12 | 13
Al |
14
Si |
15
P |
16
S |
17Cl | 18Ar |
పీరియడ్ 3 లోని మూలకాలన్నీ ప్రాకృతికంగా లభిస్తాయి. వీటన్నిటికీ కనీసం ఒకటైనా స్థిరమైన ఐసోటోప్ను ఉంది. జడవాయువు ఆర్గాన్ మినహా అన్నీ ప్రాథమిక భూగర్భ శాస్త్రం, జీవశాస్త్రానికి చాలా అవసరం.
- సోడియం (Na) ఒక క్షార లోహం. ఇది భూమి పైని మహాసముద్రాలలో సోడియం క్లోరైడ్ (టేబుల్ సాల్ట్) రూపంలో పెద్ద పరిమాణంలో ఉంటుంది.
- మెగ్నీషియం (Mg) ఒక క్షారమృత్తిక లోహము. మెగ్నీషియం అయాన్లు క్లోరోఫిల్లో కనిపిస్తాయి.
- అల్యూమినియం (అల్) ఒక పోస్ట్-ట్రాన్సిషన్ మెటల్. ఇది భూమి పైపెంకులో అత్యంత సమృద్ధిగా ఉండే లోహం.
- సిలికాన్ (Si) ఒక మెటాలాయిడ్. ఇది సెమీకండక్టర్, అనేక ఇంటిగ్రేటెడ్ సర్క్యూట్లలో ప్రధాన భాగం. ఇసుకలో సిలికాన్ డయాక్సైడ్ ప్రధాన భాగం. బయాలజీకి కార్బన్ ఎలాగో, జియాలజీకి సిలికాన్ అలాగ.
- భాస్వరం (P) DNA కు అవసరమైన ఒక అలోహం. ఇది చాలా రియాక్టివ్గా ఉంటుంది. స్వేచ్చా మూలకం రూపంలో ప్రకృతిలో ఎప్పుడూ కనుగొనబడలేదు.
- సల్ఫర్ (S) ఒక అలోహం. ఇది సిస్టీన్, మెథియోనిన్ అనే రెండు అమైనో ఆమ్లాలలో కనిపిస్తుంది.
- క్లోరిన్ (Cl) ఒక హాలోజన్. దీన్ని ముఖ్యంగా ఈత కొలనులలో క్రిమిసంహారిణిగా ఉపయోగిస్తారు.
- ఆర్గాన్ (Ar) ఒక ఉత్కృష్ట వాయువు. ఇది దాదాపు అస్సలు యాక్టివ్గా ఉండదు. ప్రకాశించే దీపాలలో అధిక ఉష్ణోగ్రతల వద్ద తీగలను సంరక్షించడానికి ఆర్గాన్ వంటి వాయువులతో నింపుతారు.
పీరియడ్ 4
[మార్చు]| గ్రూపు | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| పరమాణు # పేరు |
19
K |
20
Ca |
21
Sc |
22
Ti |
23
V |
24
Cr |
25
Mn |
26
Fe |
27
Co |
28
Ni |
29
Cu |
30
Zn |
31
Ga |
32
Ge |
33
As |
34
Se |
35Br | 36Kr |

పీరియడ్ 4 జీవులకు అవసరమైన పొటాషియం, కాల్షియంలను కలిగి ఉంటుంది. d-బ్లాక్లో తేలికైన పరివర్తన లోహాలతో ఉండే మొదటి పీరియడ్. వీటిలో ఇనుము, ప్రధాన-శ్రేణి నక్షత్రాలలో సంశ్లేషణ చేయబడిన భారీ మూలకం. భూమి యొక్క ప్రధాన భాగం. అలాగే ఈ పీరియడ్లో కోబాల్ట్, నికెల్, రాగి వంటి ఇతర ముఖ్యమైన లోహాలు ఉన్నాయి. వీటన్నిటికీ జైవిక పాత్ర ఉంది.
నాల్గవ పీరియడ్లో ఆరు p-బ్లాక్ మూలకాలు కూడా ఉన్నాయి: గాలియం, జెర్మేనియం, ఆర్సెనిక్, సెలీనియం, బ్రోమిన్, క్రిప్టాన్ .
పీరియడ్ 5
[మార్చు]| గ్రూపు | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Atomic #పేరు | 37
Rb |
38
Sr |
39
Y |
40
Zr |
41
Nb |
42
Mo |
43
Tc |
44
Ru |
45
Rh |
46
Pd |
47
Ag |
48
Cd |
49
In |
50
Sn |
51
Sb |
52
Te |
53
I |
54Xe |
పీరియడ్ 5లో పీరియడ్ 4కి సమానమైన మూలకాలున్నాయి. అదే సాధారణ నిర్మాణాన్ని అనుసరిస్తుంది కానీ ఒక అదనపు పోస్ట్ ట్రాన్సిషన్ మెటల్ ఒక తక్కువ అలోహంతో ఉంటుంది. జైవికపాత్రలు కలిగిన మూడు భారీ మూలకాలలో రెండు (మాలిబ్డినం, అయోడిన్) ఈ పీరియడ్లో ఉన్నాయి; 6వ పీరియడ్లో= ఉండే అనేక ప్రారంభ లాంతనైడ్లతో పాటు టంగ్స్టన్ బరువుగా ఉంటుంది. పీరియడ్ 5లో టెక్నీషియం కూడా ఉంటుంది, ఇది రేడియోధార్మిక మూలకాల్లో అత్యంత తేలికైనది.
పీరియడ్ 6
[మార్చు]| గ్రూపు | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Atomic #పేరు | 55
Cs |
56
Ba |
57
La |
58
Ce |
59
Pr |
60
Nd |
61
Pm |
62
Sm |
63
Eu |
64
Gd |
65
Tb |
66
Dy |
67
Ho |
68
Er |
69
Tm |
70
Yb |
71
Lu |
72
Hf |
73
Ta |
74
W |
75
Re |
76
Os |
77
Ir |
78
Pt |
79
Au |
80Hg | 81
Tl |
82
Pb |
83
Bi |
84
Po |
85
At |
86Rn |
పీరియడ్ 6, లాంతనైడ్ (అరుదైన ఎర్త్ ఎలిమెంట్స్ అని కూడా పిలుస్తారు) ఉండే ఎఫ్-బ్లాక్ను చేరిన మొదటి పీరియడ్. భారీ స్థిరమైన మూలకాలను కలిగి ఉంటుంది. ఈ భారీ లోహాలలో చాలా వరకు విషపూరితమైనవి, కొన్ని రేడియోధార్మికమైనవి. ఈ పీరియడ్ లోని మూలకాల్లో ప్లాటినం, బంగారం చాలావరకు జడత్వం కలిగినవి.
పీరియడ్ 7
[మార్చు]| గ్రూపు | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Atomic #పేరు | 87
Fr |
88
Ra |
89
Ac |
90
Th |
91
Pa |
92
U |
93
Np |
94
Pu |
95
Am |
96
Cm |
97
Bk |
98
Cf |
99
Es |
100Fm | 101Md | 102No | 103Lr | 104Rf | 105Db | 106Sg | 107Bh | 108Hs | 109Mt | 110Ds | 111Rg | 112Cn | 113Nh | 114Fl | 115Mc | 116Lv | 117Ts | 118Og |
పీరియడ్ 7లోని అన్ని మూలకాలన్నీ రేడియోధార్మికత కలిగినవే. ఈ పీరియడ్లో భూమిపై సహజంగా సంభవించే భారీ మూలకం ప్లూటోనియం ఉంది. పీరియడ్లోని అన్ని తదుపరి మూలకాలు కృత్రిమంగా సంశ్లేషణ చేయబడ్డవే. వీటిలో ఐదు (అమెరిషియం నుండి ఐన్స్టీనియం వరకు) ఇప్పుడు స్థూల పరిమాణంలో అందుబాటులో ఉన్నాయి. మిగతావి చాలా అరుదుగా లభిస్తాయి. వీటిని మైక్రోగ్రామ్ మొత్తాలలో లేదా అంతకంటే తక్కువగానే తయారు చేసారు. ఆ తరువాతి మూలకాల్లో కొన్ని, కొన్ని అణువుల పరిమాణంలో మాత్రమే ప్రయోగశాలలలో గుర్తించబడ్డాయి.
ఇవి కూడా చూడండి
[మార్చు]- గ్రూప్ (ఆవర్తన పట్టిక)
- బ్లాక్ (ఆవర్తన పట్టిక)
మూలాలు
[మార్చు]- ↑ Palmer, David (November 13, 1997). "Hydrogen in the Universe". NASA. Retrieved 2008-02-05.
- ↑ "Helium: physical properties". WebElements. Retrieved 2008-07-15.
- ↑ "Helium: geological information". WebElements. Retrieved 2008-07-15.
- ↑ Cox, Tony (1990-02-03). "Origin of the chemical elements". New Scientist. Retrieved 2008-07-15.
- ↑ "Helium supply deflated: production shortages mean some industries and partygoers must squeak by". Houston Chronicle. 2006-11-05.
- ↑ Brown, David (2008-02-02). "Helium a New Target in New Mexico". American Association of Petroleum Geologists. Retrieved 2008-07-15.
- ↑ Lithium at WebElements.
- ↑ "IARC Monograph, Volume 58". International Agency for Research on Cancer. 1993. Retrieved 2008-09-18.
- ↑ Information about chronic beryllium disease.
- ↑ "Functions of Boron in Plant Nutrition" (PDF). www.borax.com/agriculture. U.S. Borax Inc. Archived from the original (PDF) on 2009-03-20.
- ↑ . "Functions of Boron in Plant Nutrition".
- ↑ Ten most abundant elements in the universe, taken from The Top 10 of Everything, 2006, Russell Ash, page 10. Retrieved October 15, 2008. Archived ఫిబ్రవరి 10, 2010 at the Wayback Machine
- ↑ 13.0 13.1 "Structure and Nomenclature of Hydrocarbons". Purdue University. Retrieved 2008-03-23.
- ↑ Alberts, Bruce; Alexander Johnson; Julian Lewis; Martin Raff; Keith Roberts; Peter Walter. Molecular Biology of the Cell. Garland Science.
- ↑ Alberts, Bruce; Alexander Johnson; Julian Lewis; Martin Raff; Keith Roberts; Peter Walter. Molecular Biology of the Cell. Garland Science.